- 分享:
·综述·
DOI:10.3760/cma.j.cn321463-20201114-00895
收稿日期 2020-11-14 本文编辑 顾文景
引用本文:彭海玲, 谭玉勇, 刘德良. 难治性食管良性狭窄的内镜下治疗进展[J]. 中华消化内镜杂志, 2022, 39(2): 159-163. DOI: 10.3760/cma.j.cn321463-20201114-00895.
难治性食管良性狭窄的内镜下治疗进展
彭海玲 谭玉勇 刘德良
中南大学湘雅二医院消化内科 中南大学消化病研究中心,长沙 410011
通信作者:刘德良,Email:deliangliu@csu.edu.cn
【提要】 大部分食管良性狭窄可通过球囊扩张治疗获得缓解,但仍有部分狭窄多次扩张治疗无效或短期内复发,即所谓的难治性良性食管狭窄。难治性食管良性狭窄以反复吞咽困难为主要表现,严重影响患者的生活质量。随着内镜技术的发展,越来越多的技术应用于难治性食管良性狭窄的治疗,并取得了一定疗效,本文就目前的内镜治疗进展进行了综述。
【关键词】 食管狭窄; 难治性食管良性狭窄; 内镜治疗技术
基金项目:湖南省重点研发计划(2018SK21311)
Progress in endoscopic treatment of refractory benign esophageal stricture
Peng Hailing, Tan Yuyong, Liu Deliang
Department of Gastroenterology, The Second Xiangya Hospital of Central South University; Research Center of Digestive Diseases, Central South University, Changsha 410011, China
Corresponding author: Liu Deliang, Email: deliangliu@csu.edu.cn
食管良性狭窄为临床常见病、多发病,病因多种多样,如术后吻合口狭窄、溃疡、放疗、先天性食管狭窄、化学腐蚀性和内镜治疗后食管狭窄等。食管狭窄可分为单纯性狭窄和复杂性狭窄。单纯性狭窄指狭窄局限于食管一小段,管腔无迂曲,且大部分常规内镜可通过;而复杂性狭窄指狭窄长(>2 cm)、扭曲、成角或管腔极度狭窄。内镜下扩张术是食管良性狭窄的首选内镜治疗方式,大部分食管良性狭窄可通过扩张治疗获得缓解[1]。如2周1次扩张、连续5次以上治疗仍不能使食管腔直径达到1.4 cm,即为难治性食管良性狭窄(refractory benign esophageal stricture,RBES)[2]。但在我国,2周1次的治疗频率常难以维持,故RBES多指多次扩张治疗无法达到一个理想的直径、短期内复发和需要反复扩张治疗的食管良性狭窄。
RBES常见于部分吻合口狭窄、化学腐蚀、放射性狭窄和内镜治疗后狭窄。RBES主要表现为吞咽困难、吞咽疼痛,以及由此引发的一系列并发症,如营养不良、误吸、疼痛和呼吸衰竭等,严重影响患者生活质量,因此合理治疗至关重要。RBES的主要治疗目标是减轻吞咽困难的症状,避免复发和并发症。近年来,随着内镜技术的迅速发展,越来越多的内镜治疗方法已经应用于临床,为RBES患者带来了福音,本文就目前RBES的内镜治疗进展综述如下。
一、内镜下扩张治疗
RBES仍可选择内镜下扩张治疗。沙氏探条扩张和球囊扩张是目前临床上最常用的2种方法。探条扩张可同时产生纵向和放射状的压力;而球囊扩张(图1)产生的主要为放射状压力,理论上可减少食管损伤的概率。探条扩张和球囊扩张治疗食管良性狭窄的疗效相近[3],在我国以球囊扩张为主。对于复杂性狭窄,内镜下扩张治疗常疗效欠佳,需要反复扩张。

图1 食管狭窄的内镜下球囊扩张治疗 1A:吻合口狭窄;1B:扩张治疗中;1C:扩张后狭窄段食管直径变大
内镜下扩张的并发症主要有穿孔、出血、胸痛和菌血症。穿孔的发生率在0.1%~0.4%之间,复杂性狭窄的穿孔率要高于单纯性狭窄[4]。扩张治疗时应遵循从小到大、逐级扩张、双向控制(患者感觉和内镜观察),建议每次扩张增加的直径不超过3 mm[5]。扩张治疗复杂性狭窄时,在X线引导下可减少并发症的发生率[5]。
二、内镜下药物注射
内镜下药物注射主要作为其他内镜治疗的辅助治疗措施,以减少复发频率、延长治疗时间间隔,常用的药物包括糖皮质激素和丝裂霉素。
糖皮质激素可以抑制局部的炎症反应,减少纤维结缔组织形成,从而可减少内镜治疗后瘢痕形成。给药方式有口服和局部注射,推荐局部注射。局部注射时,在内镜下其他治疗结束后,于狭窄处分四个象限注射糖皮质激素,每1~2周1次,4次为1疗程。一项纳入11个研究的Meta分析结果显示,尽管吞咽困难评分在是否联合使用糖皮质激素的2组间差异无统计学意义,但联合使用糖皮质激素组可延长球囊扩张治疗间隔期[6]。也有少量研究显示局部注射可增强内镜下切开术的疗效[7⁃8]。目前糖皮质激素注射已成为浅表性食管癌ESD术后食管狭窄的主要预防方法[9]。但目前激素注射种类、频率和剂量尚未达成共识。
化疗药物丝裂霉素可干扰细胞RNA的合成,抑制成纤维细胞的增殖,从而抑制胶原的生成,临床上广泛用于预防纤维瘢痕的形成。一项纳入1个临床随机对照研究和4个队列研究的综述结果显示,局部注射丝裂霉素(0.1~1 mg/mL)可减少扩张次数、改善吞咽困难症状,且不增加并发症风险[10]。有研究显示局部注射丝裂霉素治疗腐蚀性食管狭窄效果优于糖皮质激素[11]。
内镜下药物注射的主要并发症是创面愈合延迟、出血和穿孔,尤其需要警惕迟发性穿孔的风险[12],且注射糖皮质激素尚有增加念珠菌性食管炎的风险[13]。
三、内镜下切开术
内镜下切开术是指在内镜下使用针形刀、IT刀或内镜剪刀切开狭窄段,以达到扩张的目的(图2)。目前主要有三种切开方式:单纯放射状切开、单纯放射状切开+瘢痕切除、单纯放射状切开+选择性瘢痕切除,2012年以后较多使用后两种方式[8,14]。Simmons等[15]首次报道了内镜下切开术治疗RBES,8例难治性食管吻合口狭窄患者经治疗后随访90~140 d,8例患者吞咽困难症状均得到解除。随后国内外陆续有临床研究证实该方法的疗效及安全性[16⁃20]。研究显示内镜下切开术与球囊扩张的短期疗效相近,但内镜下切开术的长期疗效优于球囊扩张,经其治疗后可获得更长的症状缓解期,延长再次治疗的间隔期[18, 21]。然而吴沛瑶等[22]发现,虽然内镜下切开术能更快缓解RBES患者的临床症状,但其缓解时间不如支架置入术。我们亦发现内镜下切开术的疗效随时间延长而降低,术后1个月吞咽困难缓解率达100%,而2年仅为60%[18]。狭窄长度是内镜下切开术后复发的独立危险因素,因此对于狭窄长度≥2 cm的患者,建议联合内镜下切开术和支架置入[19,23⁃24]。
内镜下切开术常见并发症包括疼痛、出血和穿孔,其中穿孔是最严重的并发症。在切开治疗时无法精确测量狭窄食管段的长度或者厚度是导致穿孔的主要原因[25],我们主张使用IT刀行狭窄切开,且切开深度以达到固有肌层表面或者切口底部位于狭窄两端黏膜连线构成的平面上为宜[8,14]。超声内镜引导下行内镜下切开有助于辨别狭窄深度,可减少潜在穿孔风险[26]。
四、内镜下支架置入术
食管支架因潜在并发症较多、有其他替代治疗方法和费用较昂贵等因素,目前不主张作为食管良性狭窄的一线治疗方法,但推荐作为RBES的一个可供选择的方法[27]。一项纳入18个研究的Meta分析结果显示,支架置入治疗RBES的有效率达40.5%[28]。全覆膜支架优于半覆膜支架,是目前临床治疗RBES应用最多的支架类型(图3)。一些新型支架,如药物洗脱支架、防移位支架、抗反流支架和生物可降解支架等,在临床研究中也取得了一定的效果。

图2 难治性食管良性狭窄的内镜下切开术治疗 2A:吻合口狭窄;2B:IT刀行狭窄切开术;2C:切开后狭窄口直径变大 图3 难治性食管良性狭窄的内镜下全覆膜支架治疗 3A:距门齿20 cm可见食管吻合口狭窄;3B:球囊扩张后可见狭窄长度较长;3C:置入全覆膜支架后狭窄口直径变大
金属支架、裸支架和部分覆膜支架的裸露部分容易刺激组织增生,而药物洗脱支架对食管黏膜的刺激作用较小。动物实验结果显示,紫杉醇药物洗脱支架可以轻易与食管组织分离,从而更易取出[29]。另一项研究激活素受体激酶-5抑制剂洗脱覆膜金属支架的实验结果表明,在兔食管模型中该洗脱覆膜支架可以减少支架置入继发的组织增生[30]。针对食管支架移位的问题,有专门设计的Niti‑s防移位支架[31],还有附加防移位的措施,如用钛夹将支架固定于食管黏膜或者用丝线系于支架上方并将线从鼻孔引出挂于耳朵上等[32⁃33]。抗反流支架可分为3种:带风向瓣抗反流支架、三尖瓣瓣膜支架和心型伞状瓣膜支架[34],主要用于食管胃结合部恶性肿瘤的治疗,用于RBES的研究较少。生物可降解支架可由机体代谢,不需要取出,成为近年来的热点。一项随机对照试验显示,与球囊扩张相比,生物可降解支架可减少短期内再狭窄次数,虽然两者长期疗效无明显差别,但生物可降解支架组的生活质量明显高于球囊扩张组,且生物可降解支架组因复发性狭窄首次扩张的中位时间也比球囊扩张组明显延长[35]。一项Meta分析结果显示覆膜支架与生物可降解支架的疗效无显著差别[28],因此欧洲消化内镜协会在相关指南中未对支架类型作出明确推荐[27],内镜医师可根据医疗条件、自身经验等综合因素选择支架类型,不推荐支架置入联合内镜下药物注射。
支架置入常见的并发症包括移位、肉芽组织增生致难以取出、胸骨后疼痛、出血、穿孔和吸入性肺炎等,并发症总体发生率为20.6%(95%CI:15.3%~28.1%),其中以移位发生率较高[28]。
支架置入的疗效与狭窄部位、病因等相关,食管颈部狭窄且狭窄长度≥2 cm者支架置入疗效欠佳,若经≥2次支架置入仍未取得满意疗效则建议更换治疗方案,如自助扩张或者外科手术[27]。为最大程度保证疗效、减少组织增生及支架嵌入风险,建议支架置入时间不超过3个月[27]。
五、再生医学
生物组织工程治疗的原理在于移植的材料和组织可以修复和替代损害的组织,保持这些组织的生理功能,进而加快组织愈合。移植细胞通过释放细胞因子和生长因子,进而对宿主细胞产生营养作用。目前再生医学在食管良性狭窄中的应用主要局限于内镜治疗后食管狭窄的预防,治疗方式主要包括干细胞移植、自体细胞或组织移植、皮片移植及细胞外基质支架等。
脂肪来源的干细胞由于具有类似于骨髓干细胞的特性,并且较易从脂肪组织获得,目前主要用于修复骨骼缺损、治疗克罗恩病的复杂肛瘘以及减轻激素抵抗的移植物抗宿主反应等。Honda等[36]的动物实验中,用脂肪来源的干细胞治疗EMR术后食管狭窄,术后2周实验组的食管黏膜发生挛缩的程度和吞咽困难症状较对照组轻,实验结果表明局部注射干细胞可有效预防食管狭窄形成。Ohki等[37]使用口腔黏膜细胞移植预防食管ESD术后狭窄,9例患者中有8例获得了成功,这8例患者均无吞咽困难和并发症出现,只有1例患者在术后还需要进行球囊扩张。Hochberger等[38]报道了1例使用自体胃黏膜组织固定于食管ESD术后创面的病例,5个月后发现移植处的黏膜上皮再生,并证实为胃黏膜组织,随访32个月未发生并发症。邹家乐等[39]的研究中,将自体大腿刃厚皮片移植到食管内镜黏膜下隧道剥离术后的创面,移植皮片的平均成活率为86.0%,随访8个月5例患者中有4例未发生食管狭窄。除了干细胞和自体细胞组织移植外,细胞外基质支架治疗食管狭窄也发挥了重要作用。Nieponice等[40]报道了4例食管严重狭窄患者植入细胞外基质支架的治疗效果,术后2个月食管胃十二指肠镜复查显示黏膜重塑。Badylak等[41]进行了细胞外基质生物支架和肌肉组织重建犬食管的实验研究,发现单独使用细胞外基质生物支架或单独使用肌肉组织会导致狭窄形成,但细胞外基质生物支架联合自体肌肉组织可获得食管结构上的重塑。
再生医学技术治疗食管狭窄是一个较好的选择,细胞组织易于获得,保留了细胞外基质,使其易于整合到黏膜缺损处,并发症发生率低,治疗效果令人满意。但是细胞培养周期长、成本高昂,而且大部分研究尚处于动物模型阶段,其安全性和有效性尚需要更多的临床研究证实。
六、总结
RBES的治疗仍是临床一大难题,目前有一些可供选择的治疗方法,如反复球囊扩张、内镜下切开、药物注射、支架置入、再生医学等,各种方法均有优缺点,临床实际应用时可按照以下流程进行选择:食管良性狭窄确诊后,医师可选择球囊或者探条扩张至16~18 mm,若连续5次扩张治疗仍无法缓解则考虑为RBES,可采用扩张+局部注射激素治疗或内镜下切开术进一步治疗,若再连续治疗3次仍难以缓解则可施行内镜下支架置入术治疗,若再连续2次支架置入后仍效果欠佳则可选用手术、定期球囊/探条扩张或自助扩张法(图4)。临床工作中应综合狭窄的病因、程度、医生经验、当地医疗条件和患者的意愿等选择最适宜的治疗方法。随着内镜技术和材料医学的迅速发展,生物可降解支架、再生医学技术等有望成为理想的选择。
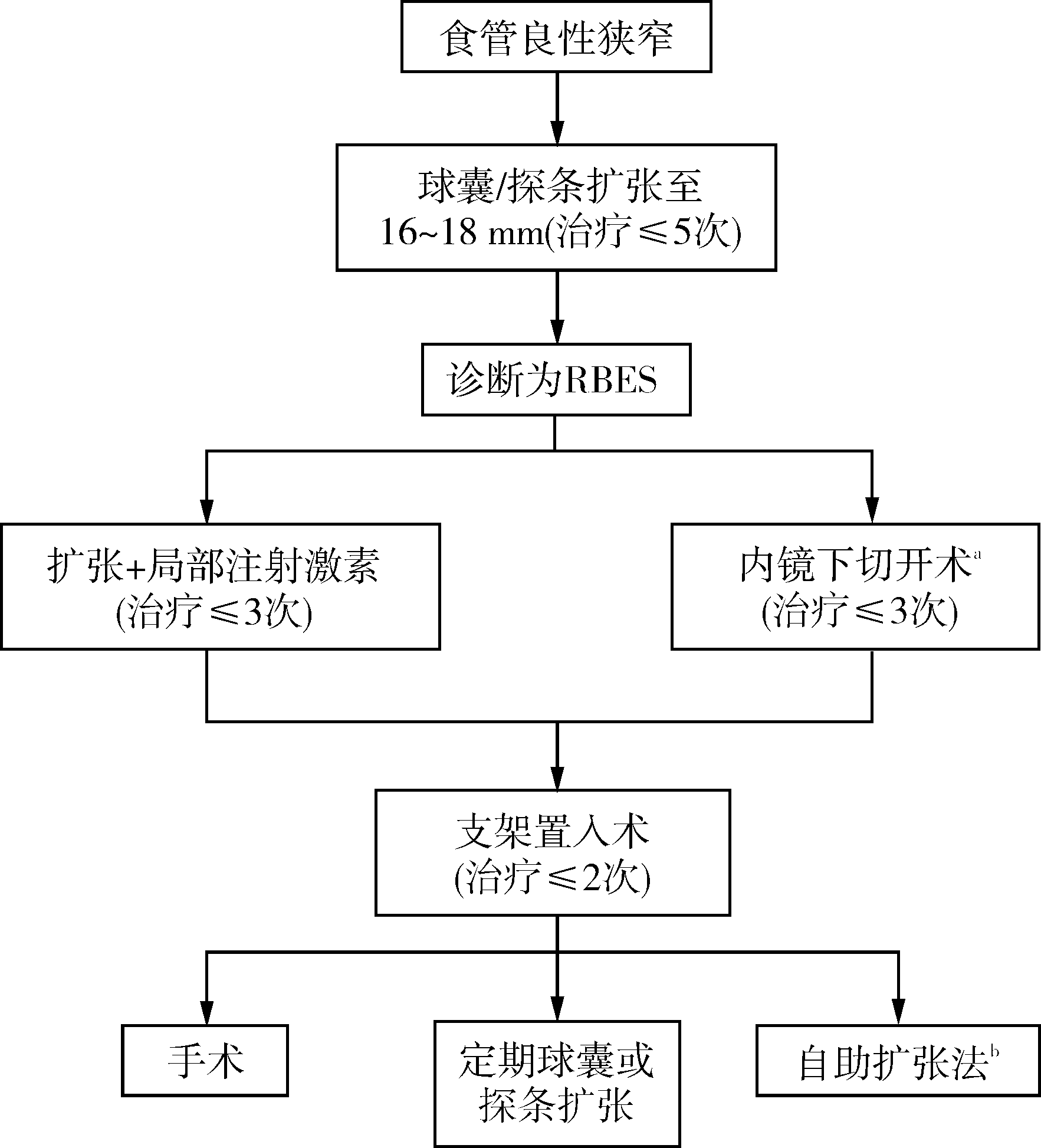
注:RBES为难治性食管良性狭窄;a:主要适用于先天性食管环和吻合口狭窄;b:适用于食管近端狭窄
图4 难治性食管良性狭窄的推荐治疗流程
利益冲突 所有作者声明不存在利益冲突
参考文献
[1] Siersema PD, de Wijkerslooth LR. Dilation of refractory benign esophageal strictures[J]. Gastrointest Endosc, 2009,70(5):1000-1012. DOI: 10.1016/j.gie.2009.07.004.
[2] de Wijkerslooth LR, Vleggaar FP, Siersema PD. Endoscopic management of difficult or recurrent esophageal strictures[J]. Am J Gastroenterol, 2011,106(12):2080-2091; quiz 2092. DOI: 10.1038/ajg.2011.348.
[3] Adler DG, Siddiqui AA. Endoscopic management of esophageal strictures[J]. Gastrointest Endosc, 2017,86(1):35-43. DOI: 10.1016/j.gie.2017.03.004.
[4] Skinner MJ, Thompson CC. Management of perforation following stricture dilation[J]. Minerva Chir, 2017,72(4):347-360. DOI: 10.23736/S0026-4733.17.07400-4.
[5] Lew RJ, Kochman ML. A review of endoscopic methods of esophageal dilation[J]. J Clin Gastroenterol, 2002,35(2):117-126. DOI: 10.1097/00004836-200208000-00001.
[6] Szapáry L, Tinusz B, Farkas N, et al. Intralesional steroid is beneficial in benign refractory esophageal strictures: A meta‑analysis[J]. World J Gastroenterol, 2018,24(21):2311-2319. DOI: 10.3748/wjg.v24.i21.2311.
[7] Nonaka K, Ban S, Aikawa M, et al. Electrocautery therapy combined with oral steroid administration for refractory corrosive esophageal stenosis prevents restenosis[J]. Esophagus, 2013,10(4):230-234. DOI: 10.1007/s10388-013-0375-7.
[8] Liang C, Tan Y, Lu J, et al. Endoscopic incision for treatment of benign gastrointestinal strictures[J]. Expert Rev Gastroenterol Hepatol, 2020,14(6):445-452. DOI: 10.1080/17474124.2020.1766966.
[9] Yang J, Wang X, Li Y, et al. Efficacy and safety of steroid in the prevention of esophageal stricture after endoscopic submucosal dissection: A network meta‑analysis[J]. J Gastroenterol Hepatol, 2019,34(6):985-995. DOI: 10.1111/jgh.14580.
[10] Deng HY, Wang WP, Lin YD, et al. Can mitomycin facilitate endoscopic dilatation treatment of benign oesophageal stricture?[J]. Interact Cardiovasc Thorac Surg, 2017,24(1):112-114. DOI: 10.1093/icvts/ivw318.
[11] Méndez‑Nieto CM, Zarate‑Mondragón F, Ramírez‑Mayans J, et al. Topical mitomycin C versus intralesional triamcinolone in the management of esophageal stricture due to caustic ingestion[J]. Rev Gastroenterol Mex, 2015,80(4):248-254. DOI: 10.1016/j.rgmx.2015.07.006.
[12] Yamashina T, Uedo N, Fujii M, et al. Delayed perforation after intralesional triamcinolone injection for esophageal stricture following endoscopic submucosal dissection[J]. Endoscopy, 2013,45 Suppl 2 UCTN:E92. DOI: 10.1055/s-0032-1326253.
[13] Hirdes MM, van Hooft JE, Koornstra JJ, et al. Endoscopic corticosteroid injections do not reduce dysphagia after endoscopic dilation therapy in patients with benign esophagogastric anastomotic strictures[J]. Clin Gastroenterol Hepatol, 2013,11(7):795-801.e1. DOI: 10.1016/j.cgh.2013.01.016.
[14] 谭玉勇, 唐瑶, 霍继荣, 等. 内镜下切开术治疗消化道良性狭窄的研究进展[J].中南大学学报(医学版),2017,42(3):352-356. DOI: 10.11817/j.issn.1672-7347.2017.03.019.
[15] Simmons DT, Baron TH. Electroincision of refractory esophagogastric anastomotic strictures[J]. Dis Esophagus, 2006,19(5):410-414. DOI: 10.1111/j.1442-2050.2006. 00605.x.
[16] 谭玉勇, 张洁, 刘德良, 等. 胃镜下绝缘头电切刀电切治疗难治性食管吻合口良性狭窄二例分析[J].中华消化杂志,2014,34(3):184-186. DOI: 10.3760/cma.j.issn.0254-1432. 2014.03.011.
[17] Tan Y, Zhang J, Zhou J, et al. Endoscopic Incision for the Treatment of Refractory Esophageal Anastomotic Strictures in Children[J]. J Pediatr Gastroenterol Nutr, 2015,61(3):319-322. DOI: 10.1097/MPG.0000000000000801.
[18] Tan Y, Liu D. Endoscopic incision for the treatment of refractory esophageal anastomotic strictures: outcomes of 13 cases with a minimum follow‑up of 12 months[J]. Rev Esp Enferm Dig, 2016,108(4):196-200. DOI: 10.17235/reed.2016.4023/2015.
[19] Hordijk ML, Siersema PD, Tilanus HW, et al. Electrocautery therapy for refractory anastomotic strictures of the esophagus[J]. Gastrointest Endosc, 2006,63(1):157-163. DOI: 10.1016/j.gie.2005.06.016.
[20] 邱敏霞, 赵心恺, 陈文妹, 等. 内镜下环周切开术治疗食管吻合口良性狭窄临床疗效观察[J].中华胃肠内镜电子杂志,2017,4(2):61-63. DOI: 10.3877/cma.j.issn.2095-7157.2017. 02.004.
[21] Muto M, Ezoe Y, Yano T, et al. Usefulness of endoscopic radial incision and cutting method for refractory esophagogastric anastomotic stricture (with video)[J]. Gastrointest Endosc, 2012,75(5):965-972. DOI: 10.1016/j.gie.2012.01.012.
[22] 吴沛瑶, 李全朋, 王飞, 等. 食管支架置入术和内镜下切开术治疗难治性食管癌术后吻合口狭窄的疗效比较[J].医学研究生学报,2019,32(6):591-595. DOI: 10.16571/j.cnki.1008-8199.2019.06.007.
[23] 谭玉勇, 王海琴, 刘佳, 等. 内镜下切开术联合支架置入治疗难治性食管良性狭窄的临床应用[J].中华消化内镜杂志,2015,32(6):408-411. DOI: 10.3760/cma.j.issn.1007-5232. 2015.06.016.
[24] 郑灿伟, 杨小巍. 内镜下切开术联合支架置入治疗难治性食管良性狭窄的临 床应用效果[J].中国保健营养,2018,28(6):131. DOI: 10.3969/j.issn.1004-7484.2018.06.196.
[25] Samanta J, Dhaka N, Sinha SK, et al. Endoscopic incisional therapy for benign esophageal strictures: Technique and results[J]. World J Gastrointest Endosc, 2015,7(19):1318-1326. DOI: 10.4253/wjge.v7.i19.1318.
[26] 胡亦懿, 杜国平, 李国华, 等. 内镜超声引导下反向切开术治疗食管良性难治性狭窄的初步应用[J].中华消化内镜杂志,2020,37(8):558-561. DOI: 10.3760/cma.j.cn321463-20200316-00199.
[27] Spaander MC, Baron TH, Siersema PD, et al. Esophageal stenting for benign and malignant disease: European Society of Gastrointestinal Endoscopy (ESGE) clinical guideline[J]. Endoscopy, 2016,48(10):939-948. DOI: 10.1055/s-0042-114210.
[28] Fuccio L, Hassan C, Frazzoni L, et al. Clinical outcomes following stent placement in refractory benign esophageal stricture: a systematic review and meta‑analysis[J]. Endoscopy, 2016,48(2):141-148. DOI: 10.1055/s-0034-1393331.
[29] Jeon SR, Eun SH, Shim CS, et al. Effect of drug‑eluting metal stents in benign esophageal stricture: an in vivo animal study[J]. Endoscopy, 2009,41(5):449-456. DOI: 10.1055/s-0029-1214607.
[30] Kim EY, Song HY, Kim JH, et al. IN-1233-eluting covered metallic stent to prevent hyperplasia: experimental study in a rabbit esophageal model[J]. Radiology, 2013,267(2):396-404. DOI: 10.1148/radiol.12120361.
[31] Verschuur EM, Homs MY, Steyerberg EW, et al. A new esophageal stent design (Niti‑S stent) for the prevention of migration: a prospective study in 42 patients[J]. Gastrointest Endosc, 2006,63(1):134-140. DOI: 10.1016/j.gie.2005.07.051.
[32] Vanbiervliet G, Filippi J, Karimdjee BS, et al. The role of clips in preventing migration of fully covered metallic esophageal stents: a pilot comparative study[J]. Surg Endosc, 2012,26(1):53-59. DOI: 10.1007/s00464-011-1827-6.
[33] Shim CS, Cho YD, Moon JH, et al. Fixation of a modified covered esophageal stent: its clinical usefulness for preventing stent migration[J]. Endoscopy, 2001,33(10):843-848. DOI: 10.1055/s-2001-17326.
[34] 马丽梅, 汤小伟, 范志宁. 食管抗反流支架的最新进展[J].中国医疗器械信息,2012(10):12-16. DOI: 10.3969/j.issn.1006-6586.2012.10.006.
[35] Walter D, van den Berg MW, Hirdes MM, et al. Dilation or biodegradable stent placement for recurrent benign esophageal strictures: a randomized controlled trial[J]. Endoscopy, 2018,50(12):1146-1155. DOI: 10.1055/a-0602-4169.
[36] Honda M, Hori Y, Nakada A, et al. Use of adipose tissue‑derived stromal cells for prevention of esophageal stricture after circumferential EMR in a canine model[J]. Gastrointest Endosc, 2011,73(4):777-784. DOI: 10.1016/j.gie.2010.11.008.
[37] Ohki T, Yamato M, Ota M, et al. Prevention of esophageal stricture after endoscopic submucosal dissection using tissue‑engineered cell sheets[J]. Gastroenterology, 2012,143(3):582-588.e2. DOI: 10.1053/j.gastro.2012.04.050.
[38] Hochberger J, Koehler P, Wedi E, et al. Transplantation of mucosa from stomach to esophagus to prevent stricture after circumferential endoscopic submucosal dissection of early squamous cell[J]. Gastroenterology, 2014,146(4):906-909. DOI: 10.1053/j.gastro.2014.01.063.
[39] 邹家乐, 柴宁莉, 令狐恩强, 等. 自体皮片移植术预防食管环周早癌内镜黏膜下隧道剥离术后食管狭窄的临床研究[J].中华消化内镜杂志,2019,36(5):312-316. DOI: 10.3760/cma.j.issn.1007-5232.2019.05.003.
[40] Nieponice A, Ciotola FF, Nachman F, et al. Patch esophagoplasty: esophageal reconstruction using biologic scaffolds[J]. Ann Thorac Surg, 2014,97(1):283-288. DOI: 10.1016/j.athoracsur.2013.08.011.
[41] Badylak SF, Vorp DA, Spievack AR, et al. Esophageal reconstruction with ECM and muscle tissue in a dog model[J]. J Surg Res, 2005,128(1):87-97. DOI: 10.1016/j.jss.2005.03.002.
热点文章
年度优秀论文
通信地址:南京市鼓楼区紫竹林3号《中华消化内镜杂志》编辑部 邮编:210003
中华消化内镜杂志 ® 2025 版权所有技术支持:北京勤云科技发展有限公司


